
Emai:marketing@yakkaa.com
業務谘詢專線:400-780-8018
Tel: +1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email: marketing@medicilon.com
地址:上海市浦東新區川大路585號
郵編:201299
電話:+86 (21) 5859-1500(總機)
傳真:+86 (21) 5859-6369







© 2023 上海hjc黄金城生物醫藥股份有限公司 保留所有權利 滬ICP備10216606號-3
滬公網安備 31011502018888號 | 網站地圖


業務谘詢
中國:
Email: marketing@yakkaa.com
業務谘詢專線:400-780-8018
(僅限服務谘詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




小核酸藥物行業發展迅速,至今已有15款藥物獲批,成為繼小分子和抗體藥物後的第三波創新藥浪潮。然而受限於遞送手段以及內含體陷阱,目前已上市的小核酸藥物僅能針對肝髒靶點。小核酸抗體偶聯藥物(AOC)結合了小核酸藥物的精準性和抗體等大分子藥物的特異性兩大優點。
AOC的意義:利用抗體藥物的特異性作用,解決小核酸藥物的靶向問題,使小核酸藥物能進入細胞內,靶向mRNA;利用抗體藥物的穩定性結構,提高小核酸的穩定性;最終促進小核酸藥物安全、有效、選擇性地治療疾病等。
核酸藥物是生物醫藥發展的前沿領域,核酸藥物靶向給藥係統是難點也是重點。目前小核酸藥物在靶向肝髒細胞/組織中已經取得了重大進展,但無法解決肝髒以外的藥物靶向遞送。且也存在劑量、濃度以及時間依賴性等問題。同時,近年來抗體藥呈現出爆發式發展,在疾病市場中所占比重越來越高。一方麵,抗體對腫瘤細胞抗原所具備的高特異性親和力是藥物靶向遞送的理想載體,利用其可以將藥物靶向遞送至腫瘤病灶部位。另一方麵,現有抗體藥物單獨使用抗腫瘤療效有限,且多數初始接受抗體治療有效的患者易產生耐藥性。
因此,目前抗體藥與其他藥物偶聯形成新型藥物的組合聯用策略越來越多。以小核酸抗體偶聯藥物(AOC) 等新遞送方法吸引了人們的廣泛關注,成為肝靶向外組織特異性遞送的有效開發手段。
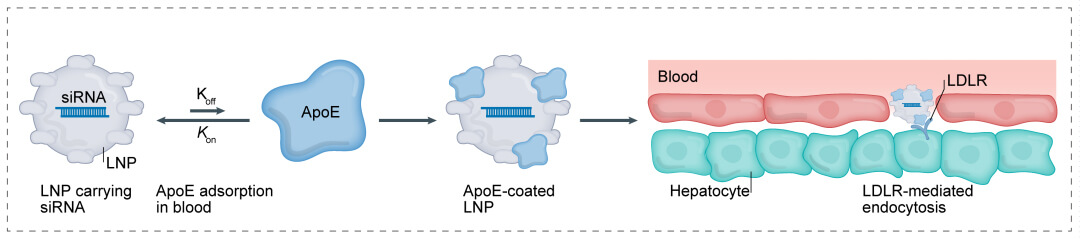
將小核酸藥物包裹在脂質納米顆粒(LNP)中,使被包裹的小核酸藥物免於降解和清除,並促進其跨細胞膜運輸到目標靶位。LNP攜帶小核酸藥物通過載脂蛋白E(ApoE)介導的內吞作用富集在肝細胞中,適用於治療肝髒相關的疾病。
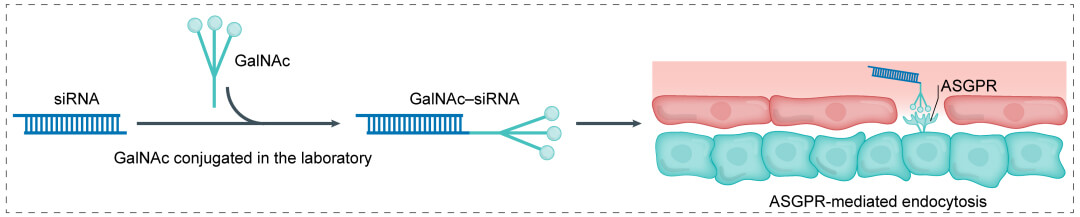
N-乙酰半乳糖胺 (GalNAc) 通過酸敏感的化學linker與小核酸藥物相連。酸敏感的linker設計可使核酸偶聯物在通過內吞作用進入細胞之後與偶聯物脫離。GalNAc可與肝細胞表麵的糖蛋白受體ASGPR特異性結合,形成的複合物通過胞吞作用進入肝細胞,此外,ASGPR能以較高的循環速率重複使用,並結合胞外其它GalNAc,最終減少給藥劑量。ASGPR僅在肝實質細胞高表達,利用GalNAc遞送可精確靶向肝髒,治療肝部疾病。
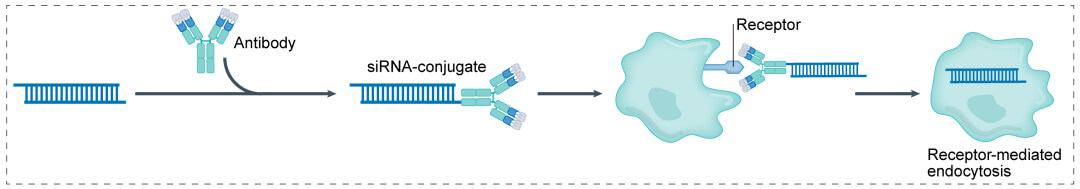
小核酸抗體偶聯藥物(AOC)的結構與ADC相似,主要由三部分構成:發揮組織靶向作用的載體,連接子(linker),作為payload的小核酸。AOC將抗體和小核酸有效地結合在一起,以實現靶向治療,可以減少治療疾病所需的藥物量,同時解決不可靶向和小核酸藥物的遞送問題。與傳統的小核酸療法相比,AOC具有更好的藥代動力學特性和更具特異性的生物分布。
小核酸藥物通常比小分子藥物具有更多的偶聯方法。以下為製備小核酸抗體偶聯藥物(AOC)的四種常用方法:
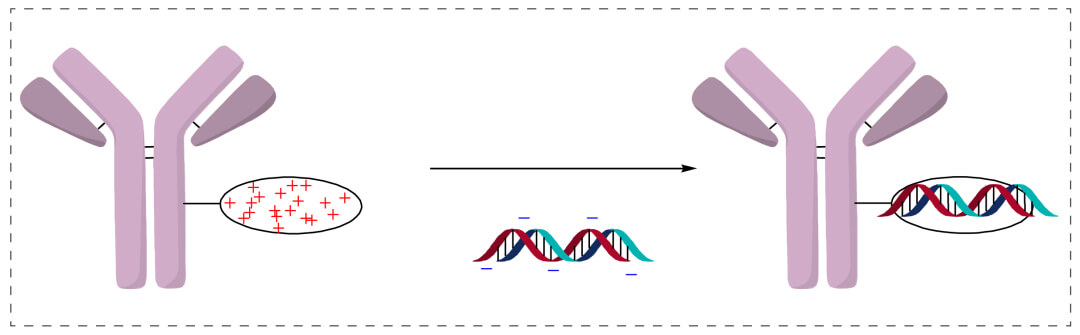
寡核苷酸主鏈帶負電荷,魚精蛋白帶正電荷。將抗體或抗體片段(Fab或scFv)與魚精蛋白構建成融合蛋白,通過魚精蛋白的正電荷偶聯帶負電荷的寡核苷酸,形成抗體偶聯寡核苷酸(antibody-oligonucleotide conjugates)。
優點是簡單,靈活;且寡核苷酸進入細胞,多陽離子複合物可充當溶酶體逃逸劑。在溶酶體中,多陽離子複合物充當質子海綿,氯離子在內部擴散以補償電荷不平衡,導致滲透膨脹,形成泄漏膜。這種溶酶體逃逸很重要,因為寡核苷酸沒有強的膜通透性。
缺點是離子相互作用是可逆的、不穩定的;且難以確定OAR值 (oligonucleotide to antibody ratios)。
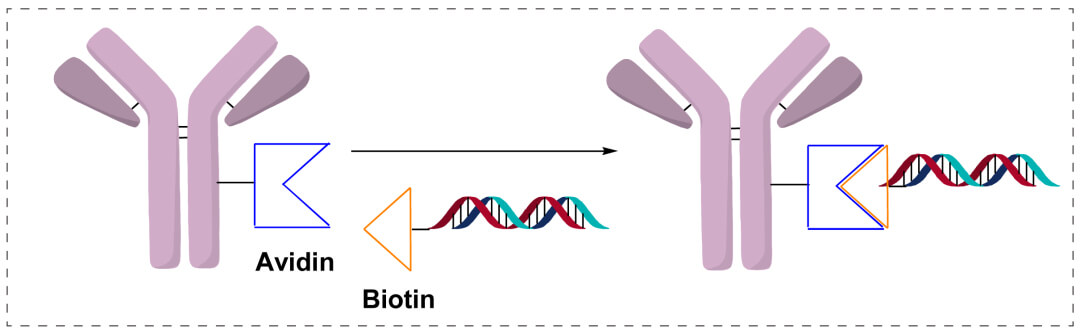
通過Avidin/Streptavidin−Biotin偶聯:將硫醇修飾的DNA化學連接到馬來酰亞胺激活的鏈黴親和素上,生成鏈黴親和素-DNA,進一步與各種生物素化蛋白非共價連接。主要應用於免疫檢測方法開發。進一步發展,直接利用鏈黴親和素的四個生物素結合位點,將生物素化的抗體和生物素化的寡核苷酸直接相連。
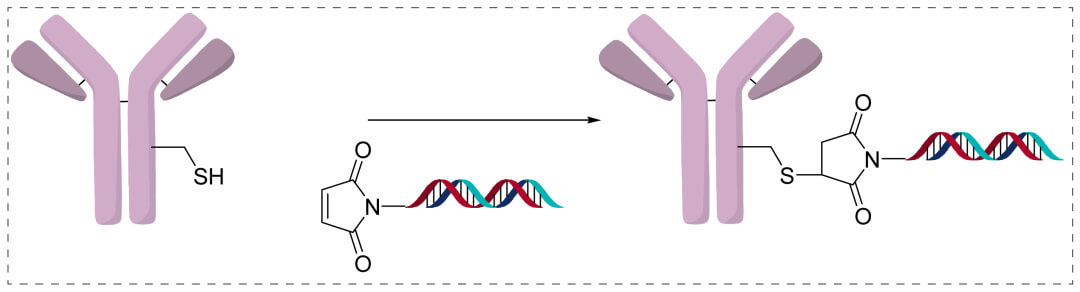
直接偶聯方法更類似於ADC藥物的偶聯策略。將一個可連接的基團添加到寡核苷酸上,並直接偶聯到抗體的賴氨酸、半胱氨酸上。連接子可以使用可裂解Linker 或者不可裂解Linker,通過定點偶聯等方式。
優點是連接子更小,更穩定;另外寡核苷攜帶連接子需要的搭手 (handhold),經過化學修飾可以與連接子相連。連接子必須存在於DNA或RNA,雙鏈退火過程中穩定。
缺點是不含溶酶體逃逸劑,因此可能會導致寡核苷酸從溶酶體中緩慢逃逸,從而影響AOC的活性。
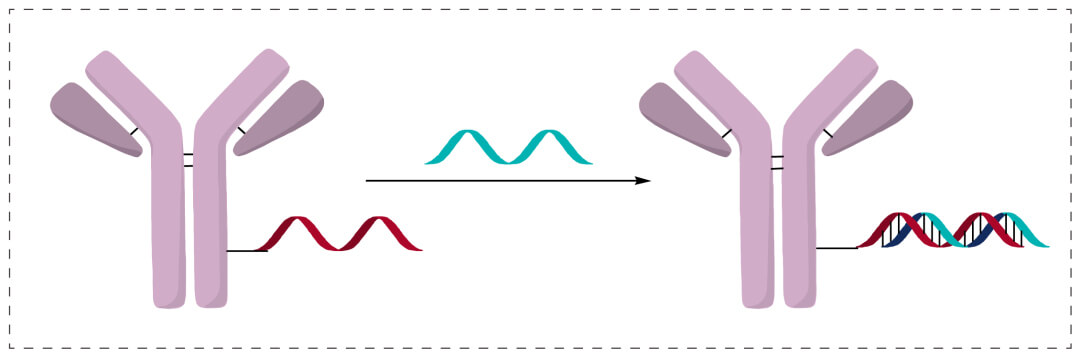
一條單鏈寡核苷酸首先偶聯到抗體上,另一條互補鏈通過雜交方式偶聯,形成一個雙鏈AOC。雙鏈雜交方法, 長度很重要。太短,形成的雜交鏈不穩定,太長則容易形成2級結構。這種雜交技術在診斷方麵非常有應用前景,但用於治療藥物,工藝挑戰大。
將抗體藥物的組織特異性優勢與小核酸的靶點特異性優勢相結合,解決目前小核酸藥物僅能通過LNP(脂質納米顆粒)、GalNAc(N-乙酰半乳糖胺)遞送係統靶向肝髒的問題,因此具備廣闊的發展空間。優勢可概況為:1、具有靶向性,增加生物利用度,減少毒作用;2、提高穩定性,增加理想半衰期,提高有效性。
❖ ADC藥物解讀(四) |一文了解ADC市場現狀及競爭格局
❖ ADC藥物解讀(一) | hjc黄金城帶您了解ADC微妙之處
[1] Kalina Paunovska, et al. Drug delivery systems for RNA therapeutics. Nat Rev Genet. 2022 May;23(5):265-280. doi: 10.1038/s41576-021-00439-4.
[2]. Julien Dugal-Tessier, et al. Antibody-Oligonucleotide Conjugates: A Twist to Antibody-Drug Conjugates. J Clin Med. 2021 Feb 18;10(4):838. doi: 10.3390/jcm10040838.
[3]. Victor Lehot, et al. Non-specific interactions of antibody-oligonucleotide conjugates with living cells. Sci Rep. 2021 Mar 15;11(1):5881. doi: 10.1038/s41598-021-85352-w.
[4]. K Sreedurgalakshmi, et al. Cetuximab-siRNA Conjugate Linked Through Cationized Gelatin Knocks Down KRAS G12C Mutation in NSCLC Sensitizing the Cells Toward Gefitinib. Technol Cancer Res Treat. 2021 Jan-Dec;20:15330338211041453. doi: 10.1177/15330338211041453.
[5]. Nicole Bäumer, et al. Antibody-coupled siRNA as an efficient method for in vivo mRNA knockdown. Nat Protoc. 2016 Jan;11(1):22-36. doi: 10.1038/nprot.2015.137.
[6]. Hua Lu, et al. Site-specific antibody-polymer conjugates for siRNA delivery. J Am Chem Soc. 2013 Sep 18;135(37):13885-91. doi: 10.1021/ja4059525.
[7]. Patrick J Kennedy, et al. Antibodies and associates: Partners in targeted drug delivery. Pharmacol Ther. 2017 Sep;177:129-145. doi: 10.1016/j.pharmthera.2017.03.004.
[8]. Guizhi Zhu, et al. Aptamer-Drug Conjugates. Bioconjug Chem. 2015 Nov 18;26(11):2186-97. doi: 10.1021/acs.bioconjchem.5b00291.
[9]. Tsukasa Sugo, et al. Development of antibody-siRNA conjugate targeted to cardiac and skeletal muscles. J Control Release. 2016 Sep 10;237:1-13. doi: 10.1016/j.jconrel.2016.06.036.
[10]. Asher Mullard. Antibody-oligonucleotide conjugates enter the clinic. Nat Rev Drug Discov. 2022 Jan;21(1):6-8. doi: 10.1038/d41573-021-00213-5.
 相關新聞
相關新聞