
Emai:marketing@yakkaa.com
業務谘詢專線:400-780-8018
Tel: +1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email: marketing@medicilon.com
地址:上海市浦東新區川大路585號
郵編:201299
電話:+86 (21) 5859-1500(總機)
傳真:+86 (21) 5859-6369







© 2023 上海hjc黄金城生物醫藥股份有限公司 保留所有權利 滬ICP備10216606號-3
滬公網安備 31011502018888號 | 網站地圖


業務谘詢
中國:
Email: marketing@yakkaa.com
業務谘詢專線:400-780-8018
(僅限服務谘詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




據統計,世界範圍內批準的大部分藥物以及近年來前500個暢銷藥物中,接近一半都是單一的對映異構體。早在1960年代,外消旋藥物分子中的非目標對映異構體所帶來的負麵影響就逐漸被認識到,許多母親由於懷孕期間服用鎮靜劑沙利度胺而造成數以百計的畸形兒的誕生,後續研究表明產生畸形的原因是活性分子的孿生兄弟-有害的鏡像異構體引起的,即沙利度胺外消旋物中的R-(+)-沙利度胺是有藥且安全的,而S-(-)-沙利度胺則具有致畸性。
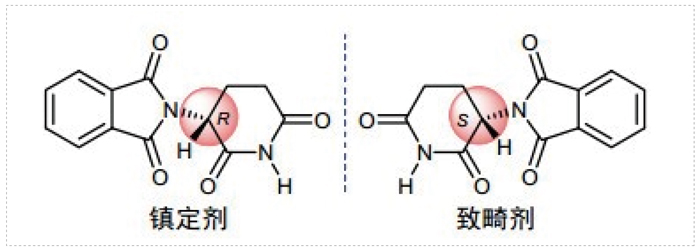
沙利度胺 (反應停)
開發單一構型異構體的動力來源於藥物安全的考量和日趨嚴格的監管要求,另外由於手性藥物的對映體在藥效學、藥代動力學等方麵存在較大差異,因此建立手性拆分的方法十分重要。目前一般是通過手性合成或者手性拆分的方法實現手性藥物單一(藥用)構型的分離和提純(手性純度提升),拆分法是製備手性藥物(特別是僅含1個手性碳)的經典方法,本文主要介紹手性拆分的相關內容。
當藥物分子中碳原子上連接有4個不同的基團時,該碳原子被稱為不對稱碳或手性碳(中心),會導致藥物分子存在異構體,如果兩個異構體之間的關係如同一個物體的立體結構在照鏡子,這個立體結構和它在鏡子中的鏡像互為對映異構體(對映體),即手性異構體。
對映異構體的物理性質基本完全相同,例如熔點、沸點、溶解度、折射率、密度、酸度等;紅外吸收、紫外、X射線粉末衍射法(XRPD)和差示掃描量熱法(DSC)也完全一致。但旋光性存在差異,對偏振光的作用不同,比旋光度數值相同,但方向相反,因此又被稱為旋光異構體。
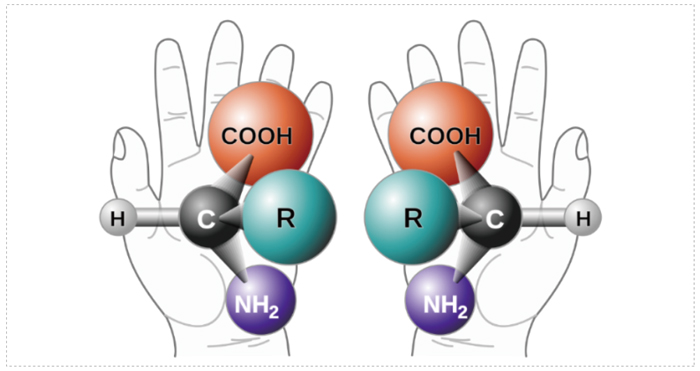
圖 1 手性的概念
等摩爾的對映異構體之間不同的分子結合方式也將會帶來三種類型的外消旋體,詳見下表:
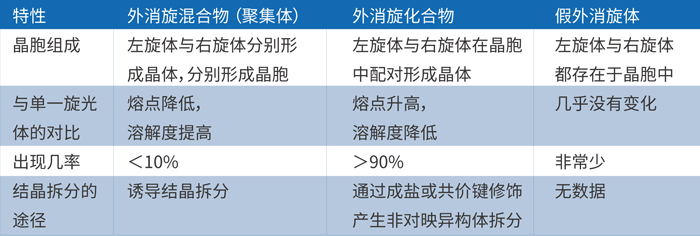
由上表可知,外消旋體的主要存在形式是外消旋混合物和化合物,假外消旋體非常罕見。
對於手性藥物而言,活性成分的分子必須與受體分子(比如受體蛋白或酶等)的空間幾何結構適配才能發揮藥效,由於藥物本身存在手性異構,因此對應的兩個異構體通常具有不同的生物活性。主要分為以下幾種類型:
❖ 兩種構型的異構體具有相似或相同的藥理活性,例如支氣管擴張藥特布他林,兩種異構體都能選擇性地激動氣道β2受體,但R構型的藥效強於S構型200倍。
❖ 一種構型有效而另一種構型無藥理活性甚至起毒害作用,例如R構型的布洛芬臨床表現為無任何藥理活性且存在胃腸道毒性;與消旋體鹽酸西替利嗪相比,鹽酸左西替利嗪的劑量減半,而療效增強,副作用減輕,無明顯抗膽堿和抗5-羥色胺的作用,中樞抑製作用較小。
❖ 藥理活性不同形成藥效互補,例如非阿片類鎮痛藥鹽酸曲馬多,兩種構型分別發揮不同藥效產生協同作用,臨床上以消旋體給藥效果更佳。
❖ 藥理活性不同形成相互拮抗,例如苯呱啶類鎮痛藥呱西那朵,右旋為阿片受體激動劑而左旋為受體拮抗劑,同時給藥將會產生拮抗作用而抵消藥效。
1992年FDA發布了關於手性藥物的指導原則,要求在向FDA提交的有關新藥申請報告中,必須包括對映體的化學、藥理學、毒理學以及藥代動力學所有相關信息以考慮以單一對映體或消旋體用藥的問題。自此,也就衍生了學術界以及製藥工藝界對於獲得光學純的手性藥物分子方法的研究熱潮。2006年12月國家食品藥品監督管理局也發布了《手性藥物質量控製研究技術指導原則》。在指導原則中規定:手性藥物的質控項目要體現其光學特征的質量控製,要求對手性藥物不同構型的生物活性(毒性)進行充分研究,並根據研究結果對產品進行質量控製。
手性拆分是指利用物理、化學或生物等多種拆分方法,將已存在的外消旋體通過分離純化得到單一光學異構體,目前主要有手性色譜拆分、直接結晶拆分和間接結晶拆分等方法。這些方法的局限在於拆分的理論產率是50%,若想要提升該理論產率則應在拆分的同時將不需要的對映異構體外消旋化,使其不斷轉化為需要的異構體,即將拆分和外消旋化同時進行,從而實現連續的拆分來提升理論產率。
原理:外消旋體通過手性色譜柱實現兩種構型的分離,手性色譜柱(Chiral HPLC Columns)是由具有光學活性的單體,固定在矽膠或其它聚合物上製成手性固定相。通過引入手性環境使對映異構體間呈現物理特征的差異,從而達到光學異構體拆分的目的。要實現手性識別,手性化合物分子與手性固定相之間至少存在三種相互作用。這種相互作用包括氫鍵、偶極-偶極作用、π-π作用、靜電作用、疏水作用或空間作用。手性分離效果是多種相互作用共同作用的結果。這些相互作用通過影響包埋複合物的形成,特殊位點與分析物的鍵合等而改變手性分離結果。由於這種作用力較微弱,因此需要仔細調節、優化流動相和溫度以達到最佳分離效果。
色譜拆分方法主要包括氣相色譜(GC)、超臨界流體色譜(SFC)、毛細管電泳(CE)和毛細管電色譜(CEC)等,其中高效液相色譜(HPLC)因其獨特的優勢成為手性分析領域最常用的一種技術。
HPLC分離法又分為手性固定相法(CSP)和手性流動相添加劑法(CMPA),前者應用廣泛。例如:抗抑鬱藥物舍曲林的合成新工藝是將手性拆分從最後一步提前到第一步,起始原料使用以多糖為固定相的手性色譜柱進行分離得到(4S)-Tetrolone,收率為98%,異構體(4R) -Tetrolone定量回收且實現消旋化。在依地普侖的生產工藝中,應用模擬移動床色譜(SMBC)實現了手性拆分。
超臨界流體色譜(SFC)是一種流動相溫度、壓力均高於或略低於臨界點的色譜技術,所用流動相有CO2、NH3、正丁烷等﹐其中CO2最為常用。超臨界流體具有粘度小、擴散係數大、密度高等特點,具有強的溶解能力,可以迅速將產物洗出,且適於分離難揮發和熱穩定性差的物質。SFC已經從對手性藥物進行分析轉向能生產幾毫克到幾百克樣品的半製備或製備規模。益康唑、貝康唑、聯苯康唑等抗真菌藥物的分離即是通過SFC實現的。
此方法適用於外消旋混合物(聚集體),利用兩種構型溶解度的差異,通過結晶的方法使得外消旋體中的理想異構體結晶析出,而另一種構型的異構體則保留在母液中,以此達到拆分的目的。為了促進目標構型析晶,可以加入晶種,例如向外消旋混合物的溶液中加入R構型的晶種,則會選擇性的析出R構型的晶體,母液就富餘了S構型的化合物;繼續加入S構型的晶種,此時就選擇性的析出S構型的化合物,該過程可以反複進行至母液中產品純度降低到雜質影響晶體析出為止。
比較經典的例子是Pasteur於1848年通過緩慢蒸發外消旋酒石酸鹽的水溶液,形成大顆粒晶體,借助放大鏡用鑷子把不同性狀的晶體分開, 獲得了(+)-/(-)-酒石酸的鈉銨鹽,但這種案例比較罕見。
該方法適用於外消旋體化合物,可采用與另一手性化合物(即拆分劑, resolving agent)形成非對映異構體混合物的方法,利用這對非對映異構體的溶解度和結晶速率的差異,通過結晶法進行分離,最後脫去拆分劑即得到單一構型的異構體,最常見的拆分劑是手性酸或手性堿。該方法技術相對成熟且成本低,應用範圍較廣,適合於大規模工業生產且工藝穩定可控。
抗驚厥藥普瑞巴林(Pregabalin)采用非對映異構體拆分法合成:1) 以(S)-扁桃酸為拆分劑對外消旋終產物進行手性拆分; 2)以(S)-α-甲基苄胺為拆分劑對關鍵中間體進行拆分,得到R型異構體,對映體過量值(enantiomeric excess, ee)接近100%,收率為35%, 再通過霍夫曼降解獲得S構型的普瑞巴林。
非對映異構體拆分已有一百多年的曆史,其技術含量雖不高,但仍然是當今應用最廣泛的一種拆分方法。結晶誘導的不對稱轉化使光學純異構體的理論收率超過50%成為可能。近年出現了組合拆分、複合拆分、包合拆分和包結拆分等新技術,是對非對映異構體拆分的有效補充。
hjc黄金城手性拆分團隊擁有經驗豐富的分析分離人員、先進的分析和製備超臨界流體色譜儀等設備,依托強大的化學和分析分離經驗技術,為客戶提供高效的手性拆分服務。確保以具有競爭力的成本、精湛的技術、最快的速度為用戶製備毫克級到千克級的手性對映體。
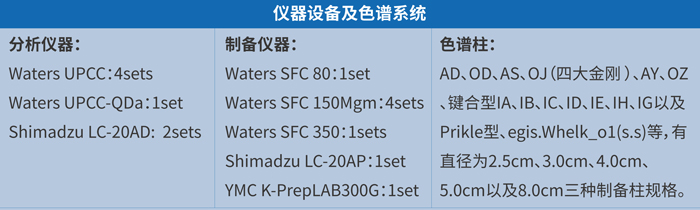

hjc黄金城手性拆分團隊積累了豐富的拆分經驗和案例,下麵簡單介紹幾個項目案例:
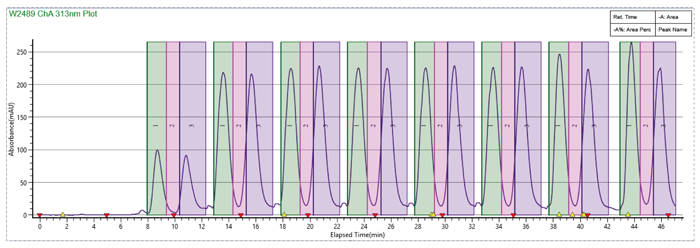
此案例中樣品有50g,溶解度大於50mg/mL,通過減少有機相比例,提高流速,增大進樣量,循環時間4min,此50g樣品在不到10h的時間內完成手性拆分。
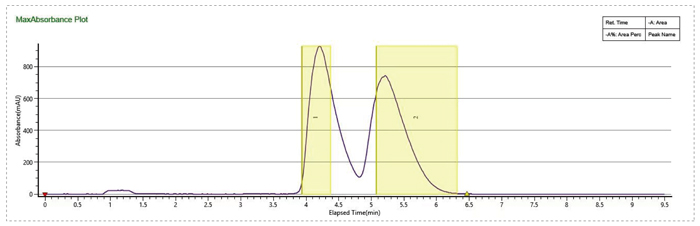
流動相MEOH+0.1%MEA,有機相比例20%,流速100mL/min,進樣量1mL,分離度不理想
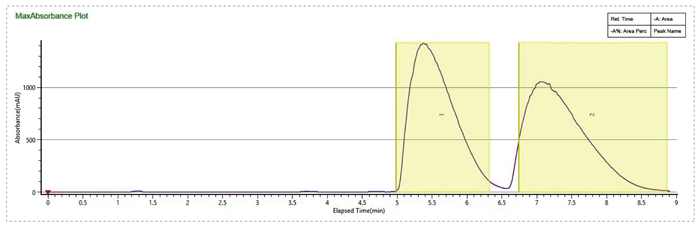
流動相MEOH+0.1%MEA,有機相比例14%,加大流速到130mL/min,進樣量提高到5mL,分離效果大大提升
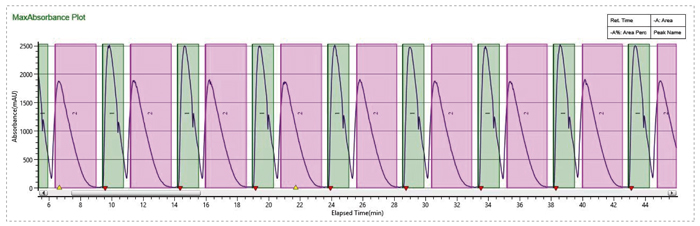
使用SFC循環進樣完成樣品快速製備
此案例中樣品有3g,但溶解性差,用甲醇溶解2L未能完全溶解,如果直接上製備,效率會非常慢,收率也會不高,通過采用混合溶劑溶解樣品,並在流動相中也添加助溶劑,製備時間大大提高,收率也提高了。此方案隻適合鍵合型填料色譜柱。
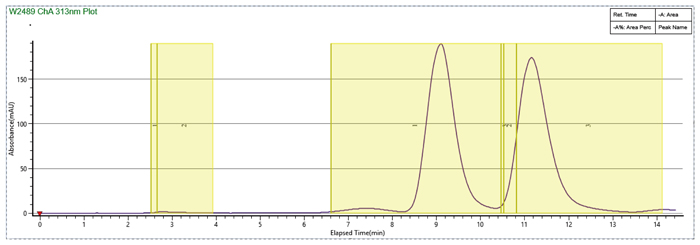
甲醇溶解,流動相比例140-30 MEOH(0.1%MEA),出峰靠後,循環時間較長
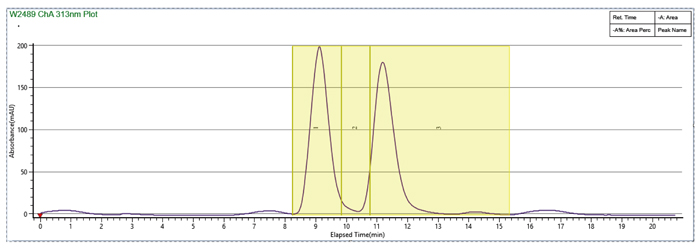
樣品溶劑和流動相體係中加入DMSO,MEOH:DMSO=2:1,峰形改善,循環時間大大縮短
使用SFC循環進樣完成樣品快速製備
此案例是一個雜質製備的例子,目標雜質峰在主峰後麵,離的比較近,分析條件為等度條件,如果直接上反相製備會比較困難。hjc黄金城的解決方案是先用SFC分析開發出富集方法,再用SFC拆分儀器把目標雜質富集,最後用反相製備二次純化,最終得到純度為95%以上的目標雜質供結構解析。
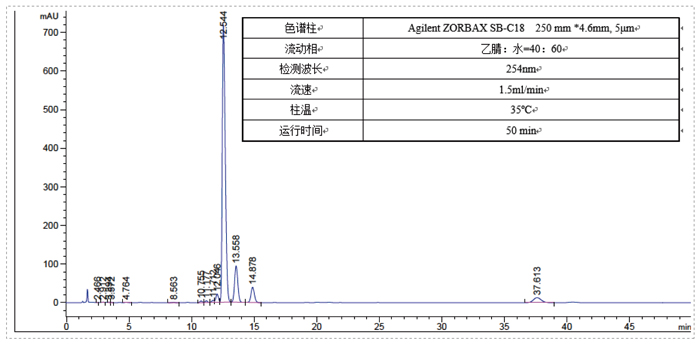
先SFC富集雜質
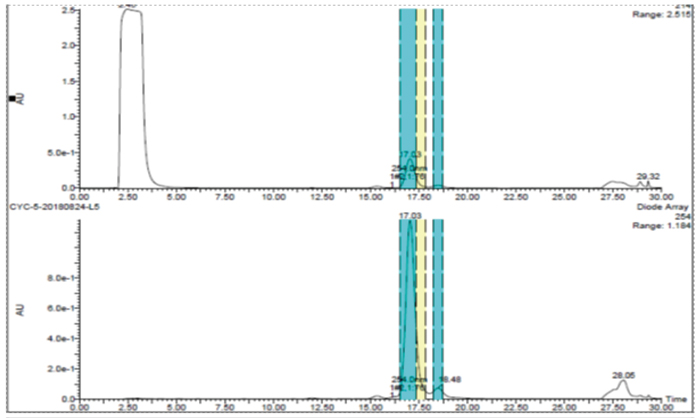
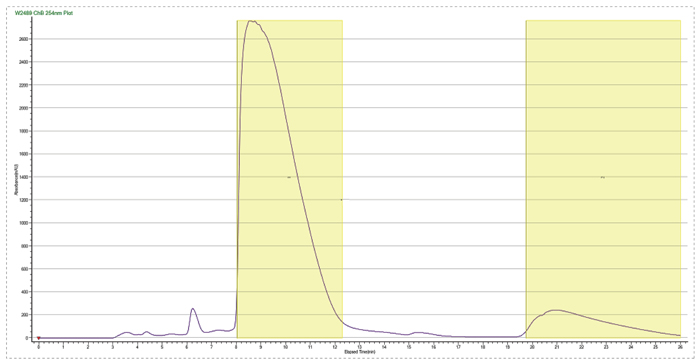
反相製備二次純化
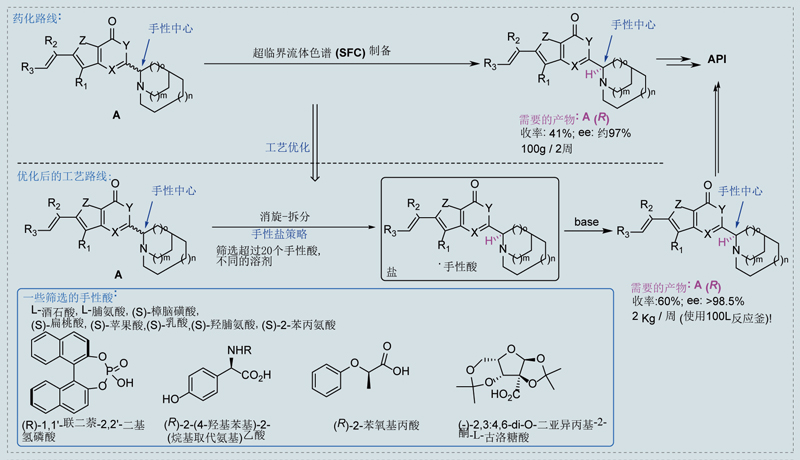
如下圖所示,此案例中化合物A僅有一個手性中心,我們需要R構型對映體。該化合物的溶解性較差,雖然嚐試了多種溶解和拆分條件,拆分的產量和效果不太理想,SFC拆分100g消旋體需要2周時間。
因為該化合物pKa呈堿性,hjc黄金城原料藥部門係統篩選了20多種手性酸和10餘種成鹽溶劑,找到了一種純化效果較好的手性酸。後續通過消旋-拆分-析晶的動態拆分方法,將拆分的收率提高至60%,ee%做到98.5%以上。工藝操作簡單,每周可以處理2kg以上的樣品,極大地提高了效率,降低了成本。
(撰稿:李同全,宋德奎; 編審:邱小龍)
參考文獻:
[1] 王耀國,趙紹磊,楊一純等,手性藥物結晶拆分的研究進展[J]. 化工學報, 2019, 70(10): 3651-3662.
[2] Stinson S C. Chiral pharmaceuticals[J]. Chemical & Engineering News Archive, 2001, 79(40): 79-97.
[3] Wang Y M, Chen A. Enantioenrichment by crystallization[J]. Organic Process Research & Development, 2008, 12(2): 282-290.
[4] 劉文強, 李莉, 手性藥物及其中間體拆分方法的研究進展[J]. 藥學學報,2018, (1): 37-46.
美研|CMC係列回顧
❖ CMC係列(一)|淺談藥物研發中原料藥工藝研究的重要性
❖ CMC係列(二)|藥學研究之世界銀屑病日
❖ CMC係列(三)|高端吸入藥物的市場格局和研究現狀
❖ CMC係列(四)|淺談手性藥物的研究策略
❖ CMC係列(五)|藥物晶型控製策略
❖ CMC係列(六)|含氮類化合物-可揮發堿性有機胺的氣相分析
❖ CMC係列(七)|新藥研究中的固態開發挑戰及應對策略
❖ CMC係列(八)|淺析ICH指導原則Q3C及未收錄殘留溶劑限度製定方法
❖ CMC係列(九)|定量核磁應用及其方法驗證/定量核磁那些事兒
❖ CMC係列(十)|藥物雜質研究策略之基因毒性雜質